碳,原子序数6,宇宙中第四多的元素。碳有15种同位素,最常见的碳有6个中子。在不稳定的碳同位素中,碳-14(6个质子8个中子)因为用于考古而闻名。碳能与绝大多数元素组成化合物。

《生活大爆炸》剧照。白板上的研究对象是石墨烯
碳单质有多种同素异形体。在这些同素异形体中,石墨和钻石的知名度较高,尽管它们均由碳原子组成,性质差别却很大:前者极软可以作为润滑剂,后者极硬可以用于研磨剂,前者导电,后者绝缘。除了石墨与钻石,碳原子还能构成其他多种结构,比如碳60与碳纳米管,这类由碳组成的中空分子称为富勒烯。碳60因为表面由20个六边形和12个五边形组成、与足球类似,也被称为足球烯。仅从富勒烯这个分类上,就可以看出有碳原子有非常多的组合方式:可以60个碳构成一个分子,也可以70个碳构成一个分子,可以有单层墙的碳纳米管,也可以有多层墙的纳米管。大量的碳60分子还可以进一步形成多种晶体,根据晶体结构不同物理性质也截然不同,例如,碳60组成的晶体可以是绝缘体、半导体,也可以是金属。碳60晶体具有超导电性,最高的超导温度可达42K,这些性质引起了人们的兴趣。不管是石墨、钻石,还是碳60、碳纳米管,只要是碳的同素异形体,在氧气中充分燃烧之后产物都是二氧化碳。
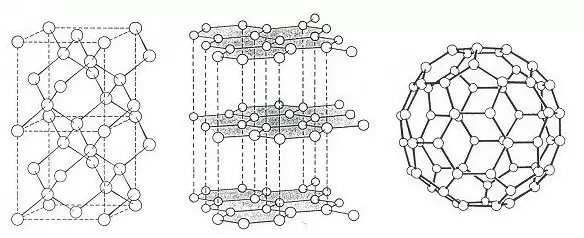
图一:从左到右,钻石、石墨与碳60的结构。(图片来源:http://www.creative-science.org.uk/25yearsC60.html)
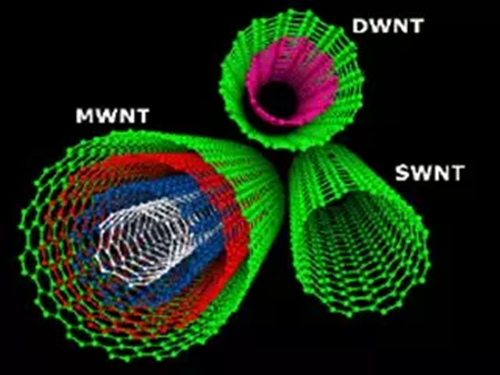
图二:多种结构的碳纳米管示例。(图片来源:
http://voitlab.com/courses/thermodynamics/index.php?title=Carbon_Nanotube_Enhanced_Epoxy)
碳能形成有规律的结构,也能形成不那么有规律的结构,如非晶态材料。煤炭主要由非晶态的碳组成,玻璃是另外一个非晶态材料的例子(还有一种观点认为玻璃是由多种非常小的晶体组成的多晶)。理想的晶体具有周期性,称为长程序;非晶态材料不具备周期性,但也不是完全无规律的,它在短距离内还具有排列规律,称为短程序。对于完全无规律的结构,物理上有一些成熟的研究方法,对于完全有规律的周期性结构,借助数学上的群论我们也有成熟的结论,比如说,周期性排布的晶体在三维空间中只能有7种晶系,14种特定排列方式。非晶态介于有序与无序之间,反而没有特别好的研究工具,目前常用的定量方法是径向分布函数:距离某粒子一定距离遇上另一个粒子的概率。对于一个周期间结构,这个函数是离散的;对于一个完全没有相互作用的大量粒子,这个函数是连续但无规律的;对于非晶态,这个径向分布函数会有一系列的极大值。非晶态的这些特性其实更接近于液体而不是晶体,它本质上不是一个平衡态,算是凝滞性太大的过冷液体,这种过冷液体转变为周期性结构的时间无限长,所以从人们的直观认识上,非晶态被认为是固体。气体、液体和晶体在物理上的本质区别,不在于人们对它们感知上的不同,而在于内部结构和周期性上的不同。

图三:上图,煤炭微观结构示意图;下图,晶格结构的SiO2(石英)与非晶态SiO2(玻璃)的区别。(图片来源:http://spie.org/x106674.xml
http://apchemrev.wikispaces.com/Structure+of+Solids%3B+Lattice+Energies)
介于晶体和液体之间就只有非晶态吗?答案是否定的。物理上有液晶,这时候分子的位置排布无序,但是分子本身是各向异性的、取向上有序;还有聚合体,此时分子形成长链,链上有一维长程序,而链间无序或者只有短程序。我们可以猜测液体最无序,非晶次之,液晶次之,聚合物比前面三者更为有序。那么,介于聚合物和晶体之间,还有其他物态吗?答案是肯定的,它就是准晶。准晶有长程的取向序而没有周期性,于上世纪八十年代在合金实验上被观测到。这类结构的理解源于上世纪七十年代英国数学家Penrose在数学上的进展,他在平面上拼接出了五重对称轴的图形。晶格的三维平移对称性不允许五重对称轴的出现,五重对称轴的Penrose瓷砖是一个拥有长程取向序但没有周期性的例子,它描述了一种准晶的排列方式。这样的数学不仅可以拼出漂亮的瓷砖,还可以参与许多具体的物理问题。准晶态可能是一个热力学平衡态,但这样的结论还需要更多的实验证据支持。
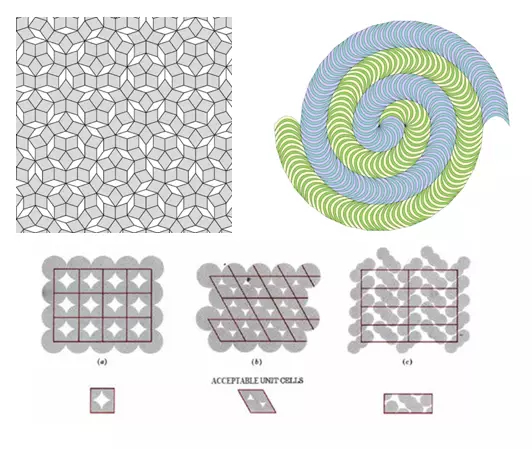
图四:左上图,二维Penrose瓷砖,尽管为了示例方便这里用了二维准晶作为例子,但是三维准晶在数学上也是可以存在的。右上图,另一个可以铺满平面但不具备平移对称性的例子。下图,二维晶格和平移对称性示例,可以看出,对于准晶,晶胞的概念是不适用的。
(图片来源:https://plus.maths.org/content/trouble-five
http://www.jianshu.com/p/9a21bf0556d7
http://chempaths.chemeddl.org/services/chempaths/?q=book/General%20Chemistry%20Textbook/Solids%2C%20Liquids%20and%20Solutions/1399/lattices-and-unit-cells)
1996年诺贝尔化学奖授予了发现碳60的三位科学家,仅仅在14年之后,碳单质的研究又获得了诺奖的承认——这回是石墨烯。上面介绍的碳的各种结构都是三维的,而石墨烯是二维晶格。石墨烯跟铜的导电能力相当,比同等结构的金属结实,比所有已知材料的导热能力都好,更重要的是,石墨烯有异常特殊的能带结构,它拥有需要考虑相对论效应的零质量狄拉克费米子。因为石墨烯的特殊物理性质,它成为了过去10年凝聚态领域的研究热点之一。石墨烯还有许多应用价值,它2004年第一次在实验室中被实现之后,10年内就有接近一万个相关专利面世。目前石墨烯在半导体工业、电池、照明等领域已有广泛的应用。将来基于石墨烯技术的触摸屏会非常薄并且不易摔坏,还能轻易弯曲甚至穿戴。
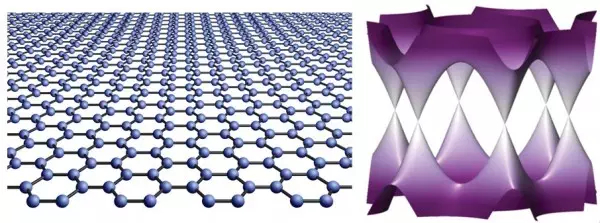
图五:左图,石墨烯的晶格结构;右图,石墨烯的能带结构,与常规半导体的抛物线型不同,它的低能能谱是线性的,并且没有能隙。
(图片来源:Rev. Mod. Phys. 83, 837-849 (2011).)
碳,原子序数6,它可以组成的结构多种多样,组合方式决定物性。






您可以选择一种方式赞助本站
赏